Резюме
Зебрата (Taeniopygia guttata) се превръща във все по-важен модел на организъм в много области на изследване, включително токсикология 1, 2, 3 поведение и памет и обучение 4,5,6. Като единствената пойни птица с секвениран геном, зебрата има голям потенциал за използване в изследвания за развитие; Ранните етапи на развитие на зебрата обаче не са добре проучени. Липсата на изследвания в развитието на зебрата може да се дължи на трудността при дисекция на малкото яйце и ембриона. Следващият метод на дисекция минимизира увреждането на ембрионалната тъкан, позволявайки изследване на морфологията и генната експресия на всички етапи от ембрионалното развитие. Това дава възможност както на ярко поле, така и на флуоресцентно качество на изображения на ембриони, тяхното използване в молекулярни процедури като in situ хибридизация (ISH), анализи на клетъчна пролиферация и екстракция на РНК за количествени анализи като REA. Количествено време-PCR (qtRT-PCR ). Тази техника позволява на изследователите да изучават ранните етапи на развитие, които преди са били трудно достъпни.
Въведение
Общата цел на тази техника е да се получат ембриони на зебра (Taeniopygia guttata) от ранните етапи на ембриогенезата за използване в широк спектър от изследвания за развитие. Зебрата се превърна в преобладаващ модел на птичи птици и се използва широко в различни области, включително токсикология 1,2, поведение 3, памет и обучение 4,5,6, сравнителна невроанатомия 7,8 и езиково развитие от 9.10. Като единствената птица птица с секвениран геном, зебрата позволява генетично и молекулярно изследване на реда Passeriformes, което представлява повече от 50% от известните видове птици 11, 12,13.
Въпреки използването на възрастни и млади зебра чинки в широк спектър от области, са проведени малко проучвания върху ембриони на зебра чинки, особено по време на ранните етапи на развитие. Това може да се отдаде на малкия размер на яйцата и ембрионите, както и на по-скорошния му статут на 14,15,16 моделен организъм за проучвания, при които пилето (Gallus gallus domesticus) преди е било използвано като 17.18.19.20 .21 преобладаваща моделна система. Въпреки това, като негласни ученици, пилетата не са подходяща моделна система за изучаване на генетичната основа на вокалното обучение, развитието на гласово обучение, наследствеността, поведението и базовите ганглийно-кортикални вериги, участващи в обучението. Двигател 10.
Важно е да се отбележи, че ембрионите на зебрата са много по-деликатни и по-лесни за увреждане от пилешките ембриони по време на дисекция и молекулярни процедури. По-специално се изисква по-голямо внимание при извършване на етапите на проникване в ембрионите на зебра. Силните детергенти и ензими, които не биха навредили на пилешки ембрион, могат да навредят на ембрионите на зебрата. От гледна точка на общите грижи, е необходимо яйцата на зебрата да се снасят в малки чашки, преди да се поставят в инкубатор, за да се предотврати счупването им при валцуване по време на инкубацията.
Зебрата чинки са податливи на поведенчески изследвания, лесно и плодотворно се възпроизвеждат през цялата година в плен и са ученици с глас. Тези характеристики позволяват използването на зебрата да отговори на необходимостта от моделен организъм, който интегрира аспектите на езика в развитието, генетиката и поведението. Методите за дисекции, описани по-долу, заедно с наскоро разработеното ръководство за поставяне на специфични за зебра чинки, превръщат зебрата във все по-полезен стандартизиран модел за развитие на организма. Получаването на ембриони в ранните етапи може да бъде обезсърчително. Този протокол позволява на изследователите лесно да получат ембриони в ранен стадий. Проучванията, изследващи ранното развитие и основите на молекулярното развитие на сложното поведение в зебрата, или токсикологичните ефекти върху развитието на други малки, птици-птици, ще намерят тази методология за дисекция полезна.
Протокол
Декларация за етика: Методите са проведени върху опитомени зебри от размножителната колония в колежа на Уилям и Мери. Всички процедури следваха насоките на RSPCA 23 и бяха одобрени от Колежа на Уилям и Мери OLAW (Служба за лабораторни грижи за животните) Осигуряване на хуманно отношение към животните (# A3713-01) и получиха одобрение от институционалната комисия за грижи и употреба на животните (IACUC) (# 2013-06 -02-8721-dacris).
1. Събиране на яйца и инкубация
2. Отстраняването на ембриона от яйцето
3. Отделяне на ембриони от извън ембрионална тъкан
4. Анализ на EdU клетъчна пролиферация. Включване и откриване на EdU в ембрионите на Zebra Finch.
5. EdU "щракнете" Протокол за реакция
Следващите стъпки се извършват върху стъклени флакони.
Представителни резултати
Преди дисекция EdU се инжектира в яйце на 2-ри ден и се оставя да се инкубира през нощта. След дисекция и фиксиране на 16 22 стадийния ембрион, EdU е визуализиран с помощта на "click" химия, позволяваща откриването на пролифериращи клетки, както се вижда в Фигура 6 (A, B, C). Важно е внимателно да се следят точките от времето, когато се поставят яйца в инкубатора и по време на дисекции, тъй като излагането на метилживак или извършването на анализ на EdU може да прекъсне напредъка в развитието. Инжектирането е направено рано на ден 0, който е денят на прибиране на реколтата, както е посочено в стъпка 1.3. Този ембрион е дисектиран приблизително 38 часа по-късно (етап 7-22). Установено е, че процентът на преживяемост е приблизително 90% (същата скорост като контролните ембриони), стига инжекционното количество да е под 478 nl.
Тази методология също така позволява дисекция за извличане на висококачествена РНК. След дисекция на ембриони от етап 16 22 беше извършена екстракция на РНК съгласно протокола на производителя, без да е необходима оптимизация, както се вижда в Фигура 7. Отстраняването на жълтъчната мембрана не беше необходимо за екстракция на РНК и последващи приложения на QRT-PCR.
Забележка: Всички фигури на ембриона са ориентирани така, че предните и задните области да са съответно отгоре и отдолу на изображенията.
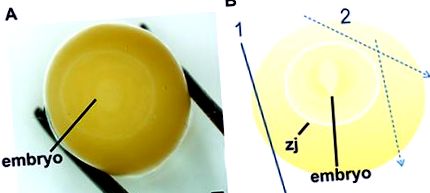
Фигура 1. Процедура за локализиране и дисекция на ембриони от зебра, етап 1-10 22. Намерете ембриона, като внимателно разточите жълтъка, докато видим е слабият бял диск (ДА СЕ). След като ембрионът е в центъра на яйчния жълтък, яйчният жълтък се дисектира на стъпки (Б) при което първото изрязване облекчава налягането на мембраната на вителина (1), а последващите разфасовки (2) граничат със зоната на свързване (zj), която е залепена към мембраната на вител. Скалите представляват 1 мм.
Фигура 2. Отстраняване на мембраната на вителина и видимост на ембрионални структури. След отстраняване на ембриона от яйчния жълтък, поставете ембриона в чаша на Петри, съдържаща 4% PFA. Ако трябва да се извърши хибридизация in situ, видимостта на ембрионалните структури е от съществено значение и може да бъде постигната чрез отстраняване на жълтъчната мембрана. (ДА СЕ). Хванете жълтъчната мембрана с много фини заострени форцепс и внимателно я отстранете от ембриона, като манипулирате ембриона директно на най-външния ръб, ако е необходимо(Б). Премахването на жълтъчната мембрана увеличава яснотата на ембрионалните структури и позволява ембрионите да бъдат изобразени или обработени с in situ хибридизация (° С). Скалите представляват 1 мм. Моля, кликнете тук, за да видите по-голяма версия на тази фигура.
Фигура 3. Цяла монтажна in situ хибридизация, извършена при развиване на ембриони от зебри, изложени на метилживак. Експресионните модели на ортодонтикула хомеобокс 2 (Otx2) се характеризират в ембриони, изложени на 0.0 ppm метилживак (A, A ') и 2,4 ppm метилживак (B, B ') чрез диетата на родителите. Експресията на doRsaI (A) и вентралната (A ') на Otx2 е видима през оптичните и средните мозъчни везикули по време на етап 12-22. Ембрионите от лечебната група бяха дисектирани по едно и също време, но се забавиха в развитието, както се вижда в дорзалната част (В) и вентрален изглед (В ') на структурите на главата, които са характерни за етап 11 22 Съкращения:. mb, среден мозък; оп, зрителна везикула. Скалите представляват 1 мм.
Фигура 4. Цял монтаж на място Хибридизация, извършена при разработване на ембриони на зебра, чийто изложени на метилживак. Експресионните модели на ортодонтикула хомеобокс 2 (Otx2) се характеризират в етап 6 22 ембриони, изложени на 0.0 ppm метилживак (A, A ') и етап 5 22 ембриони, изложени на 2,4 ppm метилживак (B, B ') чрез диетата на родителите. Съкращения: am, преден ръб на мезодермата; Не, notochord, notochord мезодерма; по, проамнион, предна бластопора; ps, примитивна линия 22. Мащабните ленти представляват 1 mm.
Фигура 5. Всички на място монтаж Хибридизация, извършена в ембриони на зебри, със сензорна сонда. (ДА СЕ) Етап 5 22 ембриони. (Б) Ранен етап 6 22 ембриони. (° С) Етап 11 22 ембриони. Скалите представляват 1 мм.
6 "src ="/files/ftp_upload/51596/51596fig6highres.jpg "/>
Фигура 6. Вграждане и защита на Edu в ембриони на зебра. EdU "click" химия се използва за откриване на клетки, пролифериращи в ембрионален стадий 16 22 (A, B, C). EdU е включен в ДНК на тимидиновото място 26, 27 и се открива с помощта на химия, щракнете върху 27. Пролиферацията е ясно видима по страничните ръбове на сомите и опашката. Панелът ДА СЕ показва пролиферация се случва изключително в задната част на ембриона и също така показва отделни пролифериращи клетки. Панелът Б. показва местата на разпространение в целия ембрион. Панелът ° С показва предната област и показва по-подробно силно пролиферативния теленцефалон (TE). Съкращения: af, околоплодна гънка; FLB, скица на крило; hlb, пъпка на задния крайник; le, везикул на лещата; ms, среден мозък; mt, Metencephalon; опт, оптична чаша; па, фарингеална дъга; см, сомитна мезодерма; tb, опашка; тенцефалон. Скалите представляват 1 мм. Моля, кликнете тук, за да видите по-голяма версия на тази фигура.
Фигура 7. Качество на РНК, извлечена от разчленени ембриони на зебра. Контролният (0.0 ppm) и 1.2 ppm метилживак ембриони се дисектират и замразяват бързо, както е описано в стъпка 3.8. Всяка лента показва РНК, извлечена от два хомогенизирани ембриона от всяка обработена група.
Дискусия
Неотдавнашното развитие на ембриологично ръководство за стадиране 22 и анотирането на генома на зебрата го правят желан модел на организма за изследвания в развитието. Малкият размер и чупливост на ембрионите на зебрата, вариращи от 3 до 7 mm в стъпки 1 - 10 22, могат да затруднят дисекциите 11, 14. Намирането и чистото отстраняване на ембриони от повърхността на жълтъка може да бъде предизвикателство. Този протокол предоставя достатъчно подробности, за да се извърши процедурата с лекота. Този протокол демонстрира критични стъпки, които обикновено не са известни, но са необходими за осигуряване на успешна дисекция. Например, от съществено значение е да оставите малък слой жълтък между ембриона и хартиения лист, за да предотвратите залепването.
Идентифицирането и отстраняването на ембриона може да бъде трудно. За да отстраните проблема с идентифицирането на ембриона върху повърхността на жълтъка, осветете светлината директно върху жълтъка, след като е бил отстранен от яйцето, и погледнете жълтъка под ъгъл 45 °, за да намерите ембриона. След като ембрионът бъде намерен, изрежете жълтъка върху хартия за претегляне, като внимавате да не разкъсате ембриона.
Ако други приложения включват изобразяване на анатомични разлики, in situ хибридизация или анализи на клетъчна пролиферация, е важно да се отстрани жълтъчната мембрана в стъпка 1-8 22 за по-добра визуализация на структурите. Ако имате проблеми с отстраняването на жълтъка или жълтъчната мембрана в ранните етапи, фиксирайте ембриона в 4% PFA, преди да го измиете в 1X PBS, за да намалите крехкостта на ембриона. Чрез първо отстраняване на жълтъчната мембрана по време на дисекцията, както е описано, структурите са ясно видими и непокътнати в ембрионите на зебра чинки след извършване на хибридизация in situ.
Ограничение на образованието е, че прилагането на дози над 478 NL води до ембрионална смъртност. Широкият диапазон на дозиране обаче позволява различни нива на пролиферативно клетъчно маркиране.
Реакцията на "щракване", използвана в този комплект, е катализираното медно (I) -алкин-азид-циклоприбавяне (Cu (I) AAC). В тази специфична реакция се включва молекула, съдържаща тимидин-алкинови аналози (UDE), активно делящи се клетки. Алкиновата група в UDE излиза от спиралната структура на ДНК и се открива чрез излагане на азидна молекула, конюгирана със зелена, флуоресцентна молекула, която се свързва със свободната алкинова група. Зелената флуоресценция показва новоразмножаващи се клетки в ембриона. Биоортогоналността на азидните и алкиновите групи предотвратява неспецифично оцветяване, тъй като тези реактивни видове не присъстват естествено в организмите. Освен това, тъй като ДНК не трябва да се денатурира, за да се случи реакцията, лесно може да се извърши по-подробен ДНК-зависим анализ 27.
Разкриване
Авторите нямат какво да разкриват.
Благодарности
Авторите благодарят на източниците си на финансиране, Програмата за бакалавърско научно образование на Медицинския институт Хауърд Хюз в Университета на Уилям и Мери; Спонсор на дарение: NIH (SMS); Номер на субсидията: R15NS067566. Те също така признават подкрепата на Колежа на Уилям и Мери, Департамент по биология и Колежа на изкуствата и науките за помощ при грижите за животните.
- КОМУНИКАЦИЯ Paramount Pictures и Coke Zero представят МИСИЯТА НЕВЪЗМОЖЕН-ПРИВЕТ ПРОТОКОЛ
- СРАВНИТЕЛЕН АНАЛИЗ НА ПРИСЪЕДИНЯВАНЕТО КЪМ СРЕДИЗЕМНОТО ХРАНЕНЕ СРЕД МОМИЧЕТА И АДЕЛЕСЦЕНТИ, КОИТО ИЗПЪЛНЯВАТ
- Създайте приложение за Android Android Blackberry iPhone Mobile App Development Freelancer
- Кетогенна диета на испански
- Документ BOE-A-2004-19313
